周磊课题组Angew. Chem. Int. Ed., “Hot Paper”:2-氯环丙烯基桥连重氮羰基化合物的合成及其环化形成多取代酚类化合物
环丙烯和重氮化合物是有机合成中最常用的合成试剂。将环丙烯和重氮官能团整合到同一分子中,可以充分利用这两种结构单元来构建复杂分子体系。例如,环丙烯基重氮甲烷经热转化生成环丁二烯可以制备新型四氢化四环衍生物(图1 a)。
环丙烯正离子(CPCs)是一类非苯型碳环芳香正离子。CPCs与亲核试剂的正负离子结合反应可以便捷地合成多取代环丙烯。由于环丙烯正离子的芳香性,亲核试剂与非对称环丙烯正离子加成的区域选择性较差(图1 b)。此外,尽管强Lewis/Brønsted酸可以促进简单易得多卤代环丙烯的脱卤来生成CPCs,但反应会导致卤素取代基的完全取代(图1 c)。如何实现多卤代环丙烯与两种不同亲核试剂的高化学、区域选择性加成仍是该领域中的一个难点。
近日,周磊教授团队以TiCl4为路易斯酸催化剂,实现了偕二氟环丙烯的两次碳-氟键官能化,将氯负离子和重氮烯醇硅醚这两种不同的亲核试剂高化学、区域选择性地加成到环丙烯正离子的相邻位置(图1 d)。

图1、环丙烯正离子与亲核试剂的加成
作者首先在无外加亲核试剂的情况下,得到了过量TiCl4与1-苯基-3,3-二氟环丙烯反应的产物单晶,发现TiCl4可以高效地攫取偕二氟环丙烯的氟原子生成环丙烯正离子,而生成的四价钛氟氯负离子不仅可以作为抗衡阴离子稳定环丙烯正离子,而且通过离子对之间的卤素交换可以选择性地转移一个氯原子到环丙烯正离子上(图2 a)。控制实验表明,不含卤素的钛盐外加氯离子并不能实现这一转化。当将TiCl4将至15 mol%时,没有足够[TiX6]2-(X = F or Cl)稳定的氯环丙烯正离子则会继续与氯离子反应,生成偕二氯环丙烯和TiF4络合的单氟环丙烯正离子(图2 b)。基于这一结果,作者设想利用重氮烯醇硅醚为第二组分的亲核试剂,与氯环丙烯正离子加成后释放硅正离子,通过形成较强的Si-F键来辅助偕二氟环丙烯的进一步脱氟。

图2. 无外加亲核试剂时TiCl4与偕二氟环丙烯的反应
结果表明,以25 mol%的TiCl4为催化剂和氯源,各种单取代和双取代的偕二氟环丙烯都能重氮烯醇硅醚反应,高化学、区域选择性地得到2-氯环丙烯基桥连重氮羰基化合物,反应产率中等至良好。反应对含有不同吸电子基团稳定的重氮烯醇硅醚也同样耐受(图3)。
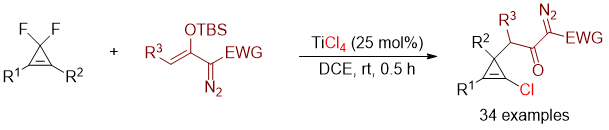
图3. TiCl4催化/介导偕二氟环丙烯与重氮烯醇硅醚的反应
该反应所得的2-氯环丙烯基桥连重氮羰基化合物,在Rh2(OAc)4的催化下可以高效、高区域选择性地分子内环异构化为多取代的苯酚(图4 a)。其中的酚羟基、Csp2-Cl以及酯基都具有丰富的转化,可以通过简单地转化得到一系列多取代苯衍生物(图4 b)。

图4. 多取代苯酚的合成及衍生化
相关研究成果发表在国际知名期刊Angewandte Chemie International Edition,并被评为热点论文,直播平台 周磊教授为论文的通讯作者,2025级博士研究生刘金鑫为论文的第一作者。感谢国家自然科学基金的支持。
论文信息:
J. Liu, J. Tian, and L. Zhou*, Synthesis of 2-Chlorocyclopropene-Tethered Diazocarbonyl Compounds and Their Cyclization to Form Poly-Substituted Phenols.Angew. Chem. Int. Ed., 2025, e202518722.
//onlinelibrary.wiley.com/doi/10.1002/anie.202518722

